 Nguyễn Vũ Quốc Huy
Nguyễn Vũ Quốc Huy
Bộ môn Phụ Sản, Đại học Y Dược Huế
TÓM TẮT
Mặc dù vaccin HPV đã và đang được đưa vào sử dụng với độ che phủ tăng dần, dự phòng ung thư cổ tử cung vẫn đòi hỏi công tác sàng lọc được thực hiện thường xuyên và rộng khắp. Dựa trên cơ sở các hiểu biết về tác động của HPV lên kiểm soát chu trình tế bào, các test phát hiện ADN HPV, protein tế bào hoặc protein HPV đã được phát triển, đặc biệt các test phát hiện ADN HPV nguy cơ cao đã được ứng dụng rộng rãi trên thế giới và bước đầu được chứng minh có giá trị trong dự phòng ung thư cổ tử cung.
Hybrid Capture II (HCII, Qiagen, USA) sử dụng phản ứng lai ADN đi kèm với khuếch đại tín hiệu là test được Cơ quan Quản lý thuốc và thực phẩm Hoa Kỳ (FDA) và Cộng đồng Châu Âu cấp phép lưu hành và sử dụng rộng rãi trên thế giới để phát hiện và phân biệt nhiễm bất kỳ type nào trong số 13 type HPV nguy cơ cao (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 và 68) với 5 type HPV nguy cơ thấp (6, 11, 42, 43, 44). Sự xuất hiện của các loại test đơn giản hơn và có chi phí chấp nhận được như careHPV trong tương lai gần, phối hợp với phương pháp soi cổ tử cung hoặc quan sát cổ tử cung với acid acetic sẽ cho phép triển khai các chiến lược tiếp cận mới với độ che phủ cao hơn và đạt được mục đích phát hiện - chẩn đoán - điều trị một cách hữu hiệu hơn.
Từ khóa: xét nghiệm HPV, ung thư cổ tử cung, dự phòng.
MỞ ĐẦU
Điều kiện tiên quyết để hình thành tổn thương tiền ung thư và ung thư cổ tử cung đã được khẳng định là nhiễm HPV nguy cơ cao. Nhiễm HPV mạn tính là giai đoạn trung gian trên con đường phát triển ung thư xâm lấn cổ tử cung. Đây là tình huống duy nhất trong lĩnh vực ung thư học, chưa có một ung thư nào ở người có được một mối quan hệ chặt chẽ với virus như vậy. So sánh với các yếu tố nguy cơ khác đã biết trong các ung thư ở người như hút thuốc lá (ung thư phổi), nhiễm virus viêm gan B (HBV) (ung thư gan), nguy cơ do HPV gây ra cao hơn nhiều. Nguy cơ tương đối của ung thư phổi do hút thuốc lá vào khoảng 10 lần, nhiễm HBV và ung thư gan khoảng 50 lần nhưng lên đến khoảng 300-500 lần giữa nhiễm HPV và ung thư cổ tử cung. Mối liên hệ chặt chẽ giữa nhiễm HPV và ung thư cổ tử cung đã dẫn đến hai dạng dự phòng: (1) sàng lọc nhiễm HPV như là một dấu chỉ điểm của tổn thương tiền ung thư cổ tử cung (CIN), (2) chủng vaccin HPV để dự phòng sự hình thành các tổn thương này [1].
Bảng 1. Các type HPV sinh dục và nguy cơ sinh ung thư
| Nguy cơ thấp | 6, 11, 40, 42-44, 53-55, 66 |
| Nguy cơ cao | 16, 18, 31, 33, 45, 26, 35, 51-52, 56, 58, 61, 67-70 |
ĐẶC ĐIỂM SINH HỌC PHÂN TỬ VÀ MIỄN DỊCH HỌC CỦA HPV
Đặc điểm sinh học phân tử
Papillomavirus là các virus ADN, hình cầu, không có vỏ, đường kính 52-55nm. Tiểu thể virus gồm một phân tử ADN chuỗi kép có khoảng 8.000 cặp base (base-pairs bp) gắn kết với histon và nằm trong một capsid protein. Capsid được tạo thành từ hai protein cấu trúc L1 (55 kDa; chiếm 80% tổng protein của virus) và L2 (70 kDa), cả hai được mã hóa bởi các gen của virus. Có thể sản xuất các tiểu thể giống virus (virus-like particles VLPs) bằng cách tạo ra L1 đơn thuần hoặc phối hợp với L2.
Bộ gen của tất cả các type HPV đều chứa 8 khung đọc mở (ORF). ORF có thể được chia thành 3 vùng chức năng: vùng giải mã sớm (E) mã hóa các protein E1-E7 cần cho sự nhân lên của virus; vùng giải mã muộn (L) mã hóa các protein cấu trúc (L1- L2) cần thiết cho sự tổ hợp hạt virion và một phần không mã hóa, được gọi là vùng kiểm soát dài (LCR), chứa các yếu tố cần thiết cho sự nhân lên và chuyển mã của ADN virus.
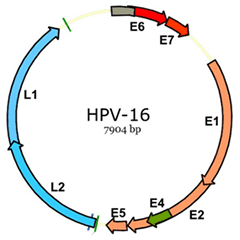
Hình 1. Bản đồ gen của HPV-16
Protein E1 và E2 của HPV có chức năng yếu tố nhận dạng nguồn gốc của sự nhân lên; E2 cũng là yếu tố điều hòa chính của hoạt động chuyển mã gen. E4 lại tham gia vào giai đoạn muộn hơn trong chu trình cuộc đời của virus, E5 có vai trò trong cả hai giai đoạn sớm và muộn. Các protein E6 và E7 tác động đến một loạt các yếu tố điều hòa âm tính của chu trình tế bào, đặc biệt lên p105Rb và p53. Trong chu kỳ cuộc đời của virus, E6 và E7 đảm bảo cho việc duy trì sự ổn định của cấu trúc và kích thích các tế bào đang biệt hóa vào lại pha S. Các protein L1 và L2 tổ hợp để tạo thành capsid bao quanh bộ gen trong giai đoạn hình thành hạt virus.
Trong các trường hợp nhiễm trùng tồn tại dai dẳng do HPV nguy cơ cao, ADN HPV có thể tích hợp vào bộ gen vật chủ, dẫn đến sự cắt bỏ các gen không cần thiết, có tác dụng điều hòa của virus như gen E2, E4, E5, L1 và L2. Do E2 mã hóa protein ức chế chuyển mã của E6 và E7, E2 mất đi làm cho E6 và E7 trở thành các protein được giải mã chính trong tế bào bị nhiễm. Các protein E6 và E7 làm bất hoạt các gen ức chế khối u p53 và retinoblastoma (Rb), phá vỡ điều hòa chu trình tế bào. Từ đó các tế bào bị nhiễm HPV nguy cơ cao hình thành sự mất ổn định bộ gen, có thể dẫn đến sự tiến triển thành ung thư.
Đặc điểm miễn dịch học
HPV tỏ ra rất hữu hiệu trong việc thoát khỏi hệ thống miễn dịch của vật chủ, do nó không lưu hành trong máu, không gây chết tế bào hay nhiễm hệ thống. Virus nhiễm vào các tế bào đáy, sẽ trưởng thành thành tế bào biểu mô và sau đó diễn ra hiện tượng chết tế bào được lập chương trình. Các virus mới được giải phóng ngay thời điểm chết tự nhiên của tế bào, do đó hệ thống miễn dịch không ghi nhận sự kiện vừa diễn ra như một dấu hiệu nguy hiểm. Kết quả là đáp ứng miễn dịch tại chỗ sẽ không được khởi động. Mặc dù vậy, đa số trường hợp nhiễm HPV sẽ được thải trừ một cách tự nhiên. Cơ chế của hiện tượng này chưa được hiểu tường tận, nhưng người ta cho rằng miễn dịch qua trung gian tế bào bẩm sinh đóng một vai trò ban đầu, sau đó là đáp ứng kháng thể. Một thời gian sau nhiễm tự nhiên ban đầu người ta phát hiện kháng thể trung hòa với nồng độ thấp trong huyết thanh và dịch tiết cổ tử cung-âm đạo. Tuy vậy nồng độ kháng thể sau nhiễm tự nhiên không đủ để bảo vệ ở các lần nhiễm sau [2].
DỰ PHÒNG THỨ CẤP UNG THƯ CỔ TỬ CUNG
Dự phòng thứ cấp bao gồm phát hiện các tổn thương tiền ung thư cổ tử cung và điều trị chúng. Các phương pháp hiện được dùng trong phát hiện các tổn thương tiền ung thư cổ tử cung bao gồm xét nghiệm tế bào cổ tử cung, quan sát cổ tử cung với dung dịch acid acetic hoặc dung dịch Lugol và xét nghiệm HPV. Sau khi được phát hiện, tổn thương tiền ung thư có thể được điều trị bằng các phương pháp cắt bỏ (khoét chóp bằng dao, dao điện, laser, LEEP) hoặc phá hủy (áp lạnh, hóa hơi bằng laser).

Bảng 2. Các phương pháp sàng lọc ung thư cổ tử cung [3]
* Phát hiện CIN2+
CÁC KỸ THUẬT XÉT NGHIỆM HPV
Xét nghiệm ADN HPV
Do không thể nuôi cấy virus HPV theo kiểu kinh điển và các test huyết thanh có độ nhạy rất thấp, chẩn đoán nhiễm HPV đòi hỏi phải phát hiện bộ gen của nó trong mẫu bệnh phẩm tế bào từ cổ tử cung. Bệnh phẩm có thể do cán bộ y tế hoặc do chính khách hàng/bệnh nhân tự lấy.
Các kỹ thuật phân tử phát hiện ADN HPV có thể được chia thành 2 nhóm: có khuếch đại và không khuếch đại. Test dùng trong nghiên cứu lâm sàng thường là test khuếch đại, còn được chia thành 2 nhóm nhỏ là khuếch đại tín hiệu và khuếch đại chính bộ gen của HPV. Hai test đại biểu cho nhóm test khuếch đại là Hybrid Capture II (HCII, Qiagen, USA) và Polymerase Chain Reaction (PCR) [4].
HCII được Cơ quan Quản lý thuốc và thực phẩm Hoa Kỳ (FDA) và Cộng đồng Châu Âu cho phép thực hiện, là phản ứng lai đi kèm với khuếch đại tín hiệu, sử dụng 2 hỗn hợp mồi ARN để phát hiện và phân biệt nhiễm bất kỳ type nào trong số 13 type nguy cơ cao (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 và 68) với 5 type nguy cơ thấp (6, 11, 42, 43, 44), tuy nhiên việc định danh chính xác thường không làm được. Số bản ADN virus tối thiểu trong mẫu để có test(+) là 5.000, đây là ngưỡng tốt hơn nhiều so với phản ứng PCR.
 |
 |
 |
| Bước 1. Lai mồi ARN với ADN đích. ADN đích kết hợp với các mồi ARN, tạo thành phức hợp lai ARN:ADN. | Bước 2. Bắt giữ phức hợp lai. Các phức hợp lai ARN:ADN được “bắt giữ” bởi các kháng thể đặc hiệu cho phức hợp. | Bước 3. Khuếch đại tín hiệu. Các phức hợp được bắt giữ sẽ được phát hiện bằng các kháng thể gắn phosphatase kiềm qua phản ứng hóa phát quang và kết quả được đọc tự động. |
Hình 2. Các bước cơ bản của kỹ thuật Hybrid Capture 2
Xét nghiệm protein
Điều hòa chu trình tế bào
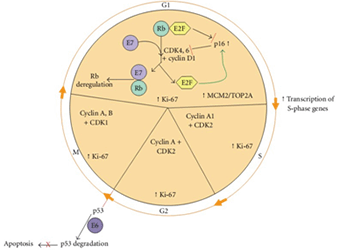
Hình 3. Các biến đổi chu trình tế bào do các gen sinh ung thư HPV E6 và E7 tại tổn thương tiền ung thư
Sự xuất hiện protein E7 của HPV làm cắt ngang hiện tượng điều hòa G1-pha S thông qua tương tác với sự kết hợp gen E2F-Rb. P16INK4a được giải phóng với khối lượng lớn do mất ức chế Rb/E2F. Tương tác giữa E6 với p53 làm cho p53 bị thoái biến, thủ tiêu hiện tượng chết tế bào được lập chương trình (apoptosis). Chất chỉ điểm Ki-67 cũng gia tăng, hệ quả của rối loạn chức năng tế bào do E6 và E7 gây ra.
Xét nghiệm protein HPV - Test E6 dạng “que thử thai”
Test E6 dạng “que thử thai” dựa trên cơ sở protein E6 của tất cả HPV nguy cơ cao gắn với các vùng PDZ, có vai trò trong tương tác protein – protein chịu trách nhiệm duy trì các chức năng ổn định tế bào, còn E6 của HPV nguy cơ thấp lại không gắn với PDZ. Tiềm năng sinh ung thư của E6 phụ thuộc vào khả năng gắn vào các vùng PDZ. Test dạng que thử thai sử dụng các kháng thể đơn dòng kháng E6 của tất cả các typ HPV nguy cơ cao. Thiết kế theo kiểu “que thử thai” cho phép triển khai dễ dàng và giảm chi phí, giúp gia tăng giá trị dự báo dương tính trong sàng lọc.
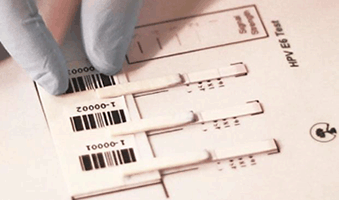
Hình 4. Test protein HPV dạng “que thử thai”
(Arbor Vita’s OncoE6™ Cervical Test)
Xét nghiệm protein tế bào vật chủ - p16INK4a
Protein p16INK4a là một chất điều hòa chu trình tế bào, có qui trình biểu hiện được kiểm soát chặt chẽ ở các tế bào bình thường. Protein ức chế khối u này ức chế các men kinase 4 và 6, có vai trò phosphoryl hóa Rb. Thông thường, Rb gắn với E2F sẽ ngăn cản sự hoạt hóa chu trình tế bào và đi vào pha S. Trong tế bào bị nhiễm HPV, gen E7 bẻ gãy liên kết của protein Rb với yếu tố chuyển mã E2F, dẫn đến sự gia tăng đáng kể nồng độ p16INK4a. Việc phát hiện nó có thể chỉ ra nhiễm trùng tồn tại các type HPV nguy cơ cao.
Cho đến nay p16INK4a được xem là một chỉ điểm nhạy và đặc hiệu của các tế bào loạn sản cổ tử cung và là một chất chỉ điểm sinh học hữu ích trong chẩn đoán và sàng lọc tổn thương ung thư cổ tử cung. Đã có nhiều kháng thể kháng p16 được nghiên cứu, tuy nhiên kháng thể dòng E6H4 (Kit CINtec, mtm laboratories AG, Heidelberg, Germany) là được dùng rộng rãi nhất.
Ứng dụng [5]:
i. Việc phát hiện là dấu chứng cho tình trạng nhiễm trùng tồn tại HPV nguy cơ cao.
ii. Giúp phân loại các trường hợp có tổn thương tế bào không rõ ràng, tạo điều kiện xác định các tế bào bất thường trên bệnh phẩm tế bào.
iii. Hỗ trợ diễn giải bệnh phẩm mô học. Việc sử dụng như một yếu tố dự báo khả năng tiến triển trên bệnh phẩm mô học cho đến nay chỉ có một số bằng chứng hạn chế.
 |
 |
 |
| CIN1 | CIN2 | CIN3 |
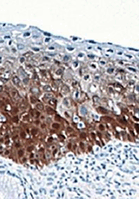
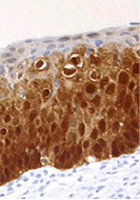
Hình 5. Nhuộm hóa mô miễn dịch p16INK4a
VAI TRÒ CỦA XÉT NGHIỆM HPV TRONG DỰ PHÒNG UNG THƯ CỔ TỬ CUNG
Một số thử nghiệm lớn gần đây
Trong khảo sát của Khan và cộng sự được công bố năm 2005 trên 20.000 phụ nữ tại Bệnh viện Kaiser Permanente (Portland, OR, Hoa Kỳ), được theo dõi bằng tế bào học trong vòng 15 năm, bệnh phẩm tế bào học được lưu trữ từ ở lần khám đầu tiên được khảo sát định danh HPV nguy cơ cao. Nguy cơ ước tính sau khi đã điều chỉnh các yếu tố mất dấu theo dõi cho thấy test HPV(-) dự báo một nguy cơ hình thành CIN3+ về sau rất thấp, ngược lại test(+) đối với HPV 16, HPV 18 hoặc HPV 31 có mối quan hệ chặt chẽ với CIN3+ [6].
Mayrand và cộng sự [7] đã so sánh 2 phương pháp xét nghiệm tế bào học và HPV trên 10.154 phụ nữ trong độ tuổi 30-69 từ Montreal và St. John’s, Canada, được phân ngẫu nhiên vào 1 trong 2 phương pháp. Độ nhạy của test HPV cho CIN2 hoặc CIN3 là 94,6% (95% CI: 84,2-100), trong lúc độ nhạy của tế bào chỉ là 55,4% (95% CI: 33,6-77,2). Độ đặc hiệu của test HPV là 94,1% (95% CI: 93,4-94,8) và tế bào học là 96,8% (95% CI: 96,3-97,3; P<0,001). Kết hợp hai test cho độ nhạy 100% và độ đặc hiệu 92,5%.
Năm 2008, Dillner và cộng sự [8] đã công bố nghiên cứu trên 24.295 phụ nữ được sàng lọc bằng test HPV, cho thấy nhóm HPV(-) có tần suất tích lũy CIN3+ rất thấp sau thời gian 6 năm, gợi ý rằng có thể xem xét để sàng lọc bằng test HPV mỗi 6 năm với độ an toàn và tính hữu hiệu chấp nhận được.
Năm 2009, Sanka và cộng sự đã công bố kết quả từ một thử nghiệm ngẫu nhiên, bắt đầu từ năm 1999 để theo dõi tác động của một lần sàng lọc bằng tế bào học, quan sát cổ tử cung với acid acetic và xét nghiệm HPV lên tần suất và tỉ lệ tử vong do ung thư cổ tử cung tại một quận ở Ấn Độ [9]. Tổng cộng đã có 131.746 phụ nữ khỏe mạnh trong độ tuổi 30-59, được phân ngẫu nhiên thành 4 nhóm, được sàng lọc với xét nghiệm HPV (34.126 phụ nữ) bằng kỹ thuật Hybrid Capture II (Qiagen), tế bào học (32.058), VIA (34.074) hoặc chỉ khám phụ khoa thông thường (31.488, nhóm chứng). Phụ nữ có kết quả sàng lọc bất thường được chỉ định soi cổ tử cung và sinh thiết, tổn thương tiền ung thư và ung thư được chỉ định điều trị theo chuẩn. Nhóm xét nghiệm HPV phát hiện được 127 trường hợp ung thư (39 trường hợp từ giai đoạn II trở lên), so với 118 trường hợp ở nhóm chứng (82 trường hợp từ giai đoạn II trở lên); tỉ suất nguy cơ phát hiện ung thư muộn ở nhóm HPV là 0,47 (95% CI: 0,32-0,69). Có 34 trường hợp tử vong do ung thư cổ tử cung trong nhóm HPV, so với 64 trường hợp trong nhóm chứng (tỉ suất nguy cơ 0,52; 95% CI: 0,33-0,83). Các tác giả kết luận rằng thậm chí trong điều kiện nguồn lực hạn chế, chỉ một vòng sàng lọc bằng xét nghiệm HPV cũng có thể giúp làm giảm số trường hợp ung thư cổ tử cung giai đoạn muộn cũng như số trường hợp tử vong.
Gần đây, Ronco và cộng sự (2010) [10] đã báo cáo về thử nghiệm ngẫu nhiên trên 47.001 phụ nữ sàng lọc bằng tế bào và 47.369 phụ nữ bằng test HPV. Kết luận rút ra từ thử nghiệm lớn này là sàng lọc bằng HPV hữu hiệu hơn tế bào học trong dự phòng ung thư xâm lấn, bằng cách phát hiện các tổn thương độ cao một cách sớm hơn và cung cấp một khoảng thời gian có nguy cơ thấp dài hơn. Tuy nhiên ở phụ nữ trẻ xét nghiệm HPV sẽ dẫn đến chẩn đoán quá mức các trường hợp CIN2 mà có thể thoái triển về sau.
Trong lĩnh vực xét nghiệm protein HPV, báo cáo mới nhất của Zhao [11] và cộng sự tại Hội nghị International Papillomavirus Conference and Clinical Workshop 09/2011 cho thấy HPV E6 là một chất chỉ điểm hứa hẹn cho việc phân biệt các trường hợp có tổn thương lành tính với ác tính. Nghiên cứu được tiến hành trên
3.241 phụ nữ chưa từng được sàng lọc, độ tuổi 25-65, sử dụng một test dạng “que thử thai” để phát hiện oncoprotein E6 của HPV 16, 18 và 45 với tư cách là test sàng lọc sơ cấp cũng như là test phân biệt trong sàng lọc ung ung thư cổ tử cung.
Kết quả cho thấy, độ nhạy và độ đặc hiệu của test HPV E6 là 44,4% (24/54) và 99,2% (3.103/3.127) để phát hiện CIN2+ và 69,6% (16/23) và 99% (3.126/3.158) để phát hiện CIN3+, trong đó tất cả 100% trường hợp ung thư đều được phát hiện. Cũng trong nghiên cứu này, độ nhạy và độ đặc hiệu của test careHPV là 96,3% và 87,8% đối với CIN2+, 100% và 87% đối với CIN3+. Khi sử dụng test HPV E6 để phân biệt các trường hợp có test careHPV(+), độ nhạy và độ đặc hiệu đạt được là 42,6% và 99,4% cho CIN2+ và 69,6% và 99,2% cho CIN3+, tỉ lệ chuyển soi cổ tử cung giảm từ 13,6% xuống chỉ còn 1,3%. Các tác giả kết luận rằng test HPV E6 có thể phát hiện tổn thương CIN3+ với độ đặc hiệu rất cao, có thể hữu ích cho cách tiếp cận sàng lọc - điều trị hoặc sàng lọc - chẩn đoán - điều trị trong điều kiện nguồn lực hạn chế mà không làm gia tăng tỉ lệ điều trị “quá mức” hoặc tỉ lệ chuyển soi cổ tử cung.
Cũng trong hội nghị này, giá trị của test careHPV 16/18/45 – test đặc hiệu cho 3 type HPV 16, 18 và 45 trong phát hiện tổn thương CIN đã được Qiao và cộng sự báo cáo [12]. Sử dụng test careHPV 16/18/45 để phân loại các trường hợp có test careHPV(+), các tác giả cho thấy độ nhạy và độ đặc hiệu của careHPV 16/18/45 là 63,0% và 97,9% cho CIN2+, 87,0% và 97,4% cho CIN3+; tỉ lệ chuyển soi cổ tử cung giảm từ 13,6% xuống còn 3,2%. Như vậy, sử dụng test careHPV đặc hiệu cho bộ gen của HPV 16/18/45 có thể giúp cải thiện độ đặc hiệu của sàng lọc sơ cấp bằng careHPV, với sự sụt giảm nhẹ về độ nhạy. Cách tiếp cận này có thể hữu ích đối với các quốc gia có nguồn lực hạn chế, ưu tiên phát hiện và chuyển tuyến để xử trí các trường hợp nguy cơ cao.
Một khi test careHPV được cấp phép sản xuất đại trà, với đòi hỏi về mặt kỹ thuật không quá cao và đặc biệt với chi phí chấp nhận được (dưới 5 USD/test), phối hợp careHPV với các phương pháp quan sát với acid acetic hoặc soi cổ tử cung sẽ cho phép phát hiện các trường hợp có tổn thương lâm sàng do HPV nguy cơ cao gây ra
- cần được xử trí - hoặc cho phép trì hoãn việc tái sàng lọc cho nhóm còn lại sau vài năm.
Khuyến cáo 2012 của USPSTF và ACS/ASCCP/ASCP [13,14]
Tháng 03/2012, các tổ chức và cơ quan liên quan ở Hoa Kỳ, bao gồm U.S. Preventive Services Task Force (USPSTF), American Cancer Society (ACS), American Society for Colposcopy and Cervical Pathology (ASCCP), American Society for Clinical Pathology (ASCP) thống nhất đưa ra khuyến cáo 2012 về sàng lọc ung thư cổ tử cung, trong đó lần đầu tiên USPSTF khuyến cáo việc thực hiện đồng thời 2 test tế bào học (TBH) và HPV cho đối tượng từ 30 tuổi trở lên.
Bảng 3. Khuyến cáo sàng lọc ung thư cổ tử cung 3/2012 của ACS/ASCCP/ASCP và USPSTF

Xác định phương pháp xử trí các trường hợp HPV(+) và TBH(-) - kết quả không phù hợp thường gặp nhất - là một thách thức lớn đối với việc đưa xét nghiệm HPV vào sàng lọc sơ cấp. Nguy cơ tổn thương CIN3+ ở nhóm phụ nữ này cao hơn so với nhóm HPV(-) và TBH(-) nhưng con số tuyệt đối vẫn thấp. Nguy cơ này cũng chưa đủ để chỉ định soi cổ tử cung ngay tức thời, bên cạnh đó nếu chuyển soi cổ tử cung tất cả các trường hợp HPV(+) (khoảng 4% các trường hợp được sàng lọc, bao gồm các phụ nữ từ 30 tuổi trở lên) sẽ làm tăng gấp đôi số trường hợp cần soi cổ tử cung so với chỉ chuyển soi cổ tử cung các trường hợp tế bào học ASC-US+.
“Hướng dẫn sàng lọc, điều trị tổn thương tiền ung thư để dự phòng thứ cấp ung thư cổ tử cung”
(Quyết định 1476/QĐ-BYT ngày 16/5/2011, Bộ Y tế) [15]
Hiện nay một số test chẩn đoán có thể phát hiện các type HPV nguy cơ cao sinh ung thư, chúng có thể được sử dụng trong lâm sàng như là test sàng lọc sơ cấp riêng biệt hoặc phối hợp với tế bào cổ tử cung.
Kỹ thuật
PCR hoặc Hybrid Capture II (HC II) hoặc bằng bệnh phẩm lấy từ âm đạo-cổ tử cung nhằm phát hiện một nhóm các type HPV nguy cơ cao sinh ung thư, còn gọi là kỹ thuật đặc hiệu theo nhóm.
PCR được dùng để định type HPV bằng bệnh phẩm lấy từ âm đạo-cổ tử cung hoặc mảnh sinh thiết cổ tử cung.
Xét nghiệm ADN HPV để sàng lọc sơ cấp
Xét nghiệm ADN HPV có độ nhạy cao và giá trị dự báo âm tính cao. Nếu test ADN HPV(-), gần như không có nguy cơ hình thành CIN3 trong vòng 6-10 năm sau đó. Điều này cho phép giãn thời gian sàng lọc và giảm số lần sàng lọc trong cuộc đời người phụ nữ.
Xét nghiệm ADN HPV để sàng lọc bổ sung
Phân biệt các trường hợp có bất thường tế bào: Xét nghiệm HPV không có vai trò trong phân biệt các trường hợp có bất thường tế bào rõ (có tổn thương CIN 1-3), do một số lớn các đối tượng này sẽ có kết quả HPV(+). Tuy nhiên nếu sử dụng test ADN HPV ở phụ nữ có các thay đổi tế bào không xác định rõ (ASC-US) sẽ có lợi ích lớn; đa số họ sẽ âm tính đối với HPV, không cần soi cổ tử cung và/hoặc sinh thiết; chỉ một nhóm nhỏ phụ nữ có ASC-US bị nhiễm HPV và cần được thăm dò tiếp theo.
Sàng lọc phối hợp bằng tế bào cổ tử cung và xét nghiệm HPV: Phối hợp xét nghiệm HPV và tế bào cổ tử cung có thể giúp tăng nhẹ độ nhạy trong việc phát hiện CIN 2-3 so với xét nghiệm HPV đơn thuần.
Xét nghiệm HPV trong theo dõi sau điều trị CIN
Xét nghiệm HPV sau điều trị tổn thương CIN bằng LEEP có thể giúp xác định các phụ nữ còn nguy cơ tái phát cao [16]. Điều trị thành công cắt bỏ vùng chuyển tiếp chứa tổn thương thường làm âm tính hóa xét nghiệm HPV đối với các type HPV gây ra tổn thương [17], mặc dù HPV cũng lây nhiễm cả ở âm đạo và âm hộ chứ không chỉ ở cổ tử cung. Người ta chưa biết rõ tại sao một khi lành hẳn vết thương do điều trị LEEP và tạo ra một vùng chuyển tiếp mới thì xét nghiệm HPV lại âm tính. Mặc dù vậy, xét nghiệm HPV(-) sau điều trị LEEP dự báo khả năng lành bệnh rất cao. Do đó, có thể xem xét sử dụng xét nghiệm HPV để thay thế tế bào học trong ứng dụng lâm sàng này với độ nhạy và giá trị dự báo âm tính cao.
Kiểm định chất lượng phòng xét nghiệm HPV [18]
Các đơn vị xét nghiệm thực hiện test HPV với mục đích phục vụ lâm sàng và sàng lọc cần tuân thủ các qui định về đảm bảo chất lượng, bao gồm nội kiểm, ngoại kiểm và công tác cải thiện chất lượng. Các biện pháp đó bao gồm:
Có các phòng riêng biệt dành cho việc chuẩn bị hóa chất, mẫu bao gồm tách ADN, khuếch đại ADN và phát hiện.
Cần có qui trình chuẩn (standard operation procedures SOP) và tuân thủ qui trình thực hành tốt phòng thí nghiệm (good laboratory practice GLP).
Có qui trình giám sát các khâu trong quá trình xét nghiệm, nội kiểm và ngoại kiểm.
KẾT LUẬN
Mặc dù vaccin HPV đã và đang được đưa vào sử dụng với độ che phủ tăng dần, dự phòng ung thư cổ tử cung vẫn đòi hỏi công tác sàng lọc được thực hiện thường xuyên và rộng khắp. Dựa trên cơ sở các hiểu biết về tác động của HPV lên kiểm soát chu trình tế bào, các test phát hiện ADN HPV, protein tế bào hoặc protein HPV đã được phát triển, đặc biệt các test phát hiện ADN HPV nguy cơ cao đã được ứng dụng rộng rãi trên thế giới và bước đầu được chứng minh có giá trị trong dự phòng ung thư cổ tử cung.
Sự xuất hiện của các loại test đơn giản hơn và có chi phí chấp nhận được như careHPV trong tương lai gần, phối hợp với phương pháp soi cổ tử cung hoặc quan sát cổ tử cung với acid acetic sẽ cho phép triển khai các chiến lược tiếp cận mới với độ che phủ cao hơn và đạt được mục đích phát hiện - chẩn đoán - điều trị một cách hữu hiệu hơn.
TÀI LIỆU THAM KHẢO
1. World Health Organization. Human papillomavirus and HPV vaccines: technical nformation for policy-makers and health professional 2007; http://www.who.int/ reproductivehealth/ publications/cancers/RHR_08_14/en/. Accessed 16 Sept 2012.
2. Bosch FX, Burchell AN, Schiffman M, Giuliano AR, de Sanjose S, Bruni L, et al. Epidemiology and natural history of human papillomavirus infections and type-specific implications in cervical neoplasia. Vaccine 2008;26(Suppl 10):K1-16.
3. UICC, UNFPA, JHPIEGO, PATH, IPPF. Comprehensive cervical cancer prevention and control: programme guidance for countries, 2011.
4. Schiffman M et al. Human Papillomavirus testing in the prevention of cervical cancer.
J Natl Cancer Inst 2011;103:1-16.
5. Brown CA, Bogers J, Sahebali S, Depuydt CE, De Prins F, Malinowski DP. Role of protein biomarkers in the detection of high-grade disease in cervical cancer screening programs. J Oncol. 2012;2012:289315.
6. Khan MJ, Castle PE, Lorincz AT, et al. The elevated 10-year risk of cer-vical precancer and cancer in women with human papillomavirus (HPV) type 16 or 18 and the possible utility of type-specific HPV testing in clinical practice. J Natl Cancer Inst. 2005;97(14):1072-1079.
7. Mayrand MH et al. Human Papillomavirus DNA versus Papanicolaou screening tests for cervical cancer. N Engl J Med 2007;357:1579-88.
8. Dillner J, Rebolj M, Birembaut P, Petry KU, Szarewski A, Munk C, et al. Long term predictive values of cytology and human papillomavirus testing in cervical cancer screening: Joint European cohort study. BMJ 2008 Oct;337:a1754.
9. Sankaranarayanan R, Nene BM, Shastri SS, Jayant K,Muwonge R, Budukh A, et al. HPV screening
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...
Sách ra mắt ngày 14 . 11 . 2025 và gửi đến quý hội viên trước ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...








